아밀로이드 영상 양성인 알츠하이머병에서의 렘수면행동장애 유병률 연구
The Prevalence of Rapid Eye Movement Sleep Behavior Disorder in Amyloid Positron Emission Tomography Positive Alzheimer’s Disease
Article information
Trans Abstract
Objectives
Rapid eye movement (REM) sleep behavior disorder (RBD) is well known as a prodromal symptom of neurodegenerative disease, especially α-synucleinopathy. In the previous literature, it has been reported the incidence rate of RBD in Alzheimer’s disease (AD) is about 10%. This incidence rate is relatively low, if we consider that nearly half of AD patients also have Lewy body pathology. The objective of this study is to determine the incidence rate of RBD among patients with AD, confirmed by amyloid positron emission tomography (PET) image.
Methods
We enrolled 57 patients with clinically probable AD patients who identified AD pathology in amyloid PET scan. RBD was evaluated with REM sleep behavior disorder questionnaire-Korean vesion (RBDQ-KR), which validated the RBD screening questionnaire as Korean version to confirm RBD. Detailed neuropsychological tests were measured using the Seoul Neuropsychological Screening Battery (SNSB).
Results
We analyzed RBDQ-KR data collected from 57 AD patients. Dementia due to AD was 36 patients (63.2%) and mild cognitive impairment (MCI) due to AD was 21 (36.8%). AD with RBD was 14 (24.6%). Among these, AD dementia with RBD was 13 (36.1%), and MCI due to AD with RBD was 1 (4.8%). There were no significant differences in cognitive function between the patients with or without RBD, evaluated by detailed neuropsychological test.
Conclusions
In this study, the incidence of RBD in AD was not rare; therefore, if the patient shows symptoms of RBD, we should not rule out AD.
서 론
렘수면행동장애[rapid eye movement(REM) sleep behavior disorder, RBD]는 1986년 Schenck 등이 처음 명명한 임상군으로 렘수면(REM sleep) 동안 꿈 내용을 행동으로 하고 과격한 행동을 보이는 것을 특징으로 한다[1]. 정상적인 렘수면 동안 안구 운동을 제외한 근육 마비가 생기지만 RBD 환자는 이러한 근육 활동 억제가 적절히 이루어지지 않는다. 따라서 수면질환 분류 진단기준에 따라 환자의 특징적인 병력과 비디오 수면다원검사를 통하여 환자의 렘수면 동안 이상행동 및 턱 근전도 활동 증가소견을 확인함으로써 RBD를 진단할 수 있다. RBD의 유병률은 정확히 알려져 있지는 않지만 대략적으로 0.5~1% 정도로 알려져 있으며, 노인에서는 약 2%까지도 보고되고 있다[2,3].
RBD는 그동안 수면장애로 많은 연구가 이루어졌으나 최근에는 레비체(Lewy body) 병리로 인해서 발생하는 레비체질환(Lewy body disease)의 전구증상으로써 중요성이 강조되고 있다. RBD는 파킨슨병의 33~50%, 다계통위축증의 80~95%, 레비체치매의 80%에서 파킨슨 증상 발생 5~10년 전에 나타난다고 알려져 있다[4-9]. 하지만 최근 비정상 아밀로이드 침착을 주된 병리소견으로 하는 알츠하이머병(Alzheimer’s disease, AD) 환자에서도 약 10% 미만에서 RBD를 보였다는 보고가 있었다[10-12]. 이러한 연구결과들은 알츠하이머병에서 가장 중요한 뇌조직의 베타 아밀로이드 침착을 확인하지 않고 임상적으로 진단한 환자들을 대상으로 한 연구를 통해 밝혀졌다. 하지만 알츠하이머병에서도, 연구에 따라 약 40~50%에서 레비체 병리소견을 공유한다는 최근 연구결과를 고려할 때 AD 환자에서 RBD의 유병률이 저평가되었을 가능성이 있다[13-17]. 이에 본 연구에서는 아밀로이드 positron emission tomography(PET) 영상을 통해 뇌조직의 베타아밀로이드 병리의 침착소견을 확인한 알츠하이머병 환자를 대상으로 RBD가 얼마나 나타나는지 확인하고자 했다.
방 법
대 상
본 연구는 전향적 단면연구로 2019년 1월부터 2019년 4월까지 길병원 뇌건강센터 외래에 인지기능 저하를 주소로 내원한 환자들 중 아밀로이드 양전자단층촬영(amyloid PETCT)에서 양성소견을 보인 65명의 알츠하이머병 환자들 중, 신경심리검사 결과가 불충분한 환자 8명을 제외한 57명의 알츠하이머병 환자를 대상으로 하였다. 알츠하이머병은 미국 국립노화연구소 및 알츠하이머협회(National Institute on Aging and the Alzheimer’s Association, NIA-AA)의 기준에 따라 진단된 dementia due to AD와 mild cognitive impairment due to AD 환자를 모두 포함하였다[18,19]. 양전자단층촬영에는 flutemetamol, florobetaben, florbetapir를 사용하였고, 뇌 구조 영상은 Simens 3T MRI를 이용했다.
연구의 진행
연구 참여에 동의한 알츠하이머병 환자들에게 한국판 RBD 선별검사(REM sleep behavior disorder questionnaire-Korean version, RBDQ-KR) 작성에 대하여 교육한 후, 선별 검사지를 작성하도록 하였다[20]. 환자가 설문 작성에 어려움을 호소할 경우 함께 생활하는 보호자와 같이 작성하도록 하였다. 검사 항목은 평상시의 경험 및 최근 1년간의 증상 발생빈도에 대하여 조사하였고, 한국판 RBD 선별검사 표준화 연구 진행 방식과 동일하게 환자가 기억나지 않을 경우 0점으로 간주하였다.
신경심리검사
모든 환자들은 한국판 간이정신상태검사[21], 치매척도검사[22], 임상치매평가척도[23], 한국판 RBD 선별검사[24], 그리고 일상생활수행능력검사[Korean instrumental activities of daily living(ADL)]를 포함한 서울신경심리검사(Seoul Neuropsychiatric Screening Battery, SNSB)를 진행하였다[25,26]. 신경심리검사는 RBD 선별검사에서 최근 1년간의 빈도를 확인하는 점을 고려하여 최근 1년 이내의 검사 결과를 기준으로 자료를 수집 및 분석하였다.
SNSB는 다양한 인지기능을 종합적으로 평가하여 치매평가에 사용할 수 있도록 2003년 강연욱 등에 의해 국내에서 개발한 검사 총집으로, 주의집중력(digit span: forward/backward, letter cancellation), 언어능력 및 그와 관련된 기타 능력들(spontaneous speech, comprehension, repetition, reading, writing, finger naming, calculation, body part identification, Korean Boston naming test, praxis), 시공간적 지각 및 구성 능력(block design, clock drawing test, Rey complex figure test copy), 기억력(Seoul verbal learning test, Rey complex figure test memory) 및 전두엽 기능[go no go test, fist edge palm test, controlled oral word association test (COWAT), luria loop test, alternating hand movement, color word stroop test]에 대한 표준화된 평가 항목으로 구성되어 있다.
한국판 렘수면행동장애 선별검사(RBDQ-KR)
알츠하이머병 환자들의 RBD 동반 여부는 RBDQ-KR을 이용하여 조사하였다. 이 설문지는 2010년 Li 등에 의해 개발된 REM sleep behavior disorder questionnaire-Hong Kong (RBDQ-HK)의 한국어판으로[27], 꿈과 관련된 5개의 문항과 수면 기간 보인 이상행동과 관련된 8개의 문항을 합쳐 총 13개의 질문으로 구성되어 있고, 이에 대하여 환자(또는 수면파트너가 동반하여)가 설문지에 표시할 수 있도록 이루어져 있다. 설문지는 총 100점 만점으로 일생 동안의 경험을 묻는 항목(0~20점)과 최근 1년간 얼마나 자주 경험했는지에 대한 빈도를 묻는 항목(0~80점)을 구분하여 설문하고, 이상행동과 관련된 문항에 대해서는 가산점을 부여하여 평가하도록 되어 있다. RBDQ-HK는 18/19점을 절단점으로 했을 때 민감도 82.2%, 특이도 69.9%를 보였고, RBDQ-KR은 18.5점에서 민감도 93.3%, 특이도 89.5%로 최적의 절단점을 보였고, RBD에 대한 선별검사로서의 유용성과 타당성을 보였다[20].
일상생활 수행 능력(ADL scales)
대소변 가리기, 화장실 사용하기, 목욕하기, 식사하기 등의 기본적 일상생활 능력 평가와 전화 사용, 물건 구입, 재정 관리, 취미 생활하기 등의 도구적 일상생활 능력 평가를 위하여 Kim이 신뢰도와 타당도를 분석한 한국어판 바텔 일상활동 지표(Korean Barthel ADL index) 및 2003년 Kang 등이 신뢰도와 타당도를 검증한 한국어판 도구적 일상활동 지표(Korean instrumental ADL index) 검사를 진행하였다[25,28].
통계 처리
평가 변수에 대한 분석은 환자가 작성한 설문 및 의무기록 데이터베이스를 기반으로 하였다. 설문을 모두 작성하지 않았거나 신경심리검사를 시행하지 않은 경우 통계 분석에서 제외시켰다. RBDQ-KR에서 RBD가 확인된 환자와 확인되지 않은 환자로 구분하여 알츠하이머병과의 연관성을 분석하였다. 환자들의 RBD의 동반 여부와 이에 따른 인지기능의 차이를 확인하기 위하여 카이제곱검정을 하였다. 통계적 유의성은 p<0.05 수준으로 산정하였다. 모든 수집된 자료는 SPSS 17.0(SPSS Inc., Chicago, IL, USA)을 이용하여 분석하였다.
결 과
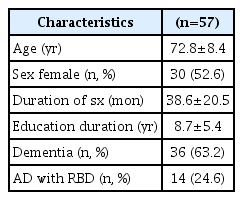
대상 환자 총 57명의 임상 양상을 Table 1에 요약하였다. 환자들의 평균 연령은 72.8±8.4세였다. 이 중 남자 27명(47.4%)이었고, 여자 30명(52.6%)이었다. 환자들은 평균적으로 8.7±5.4년 교육받았고, 인지 저하는 연구 시점으로부터 38.6±20.5달 전부터 시작되었다. 알츠하이머병 환자 중 14명(24.6%)에서 RBD를 보였다.
RBD는 알츠하이머병 치매 환자에서 13명(36.1%)으로 경도인지장애의 1명(4.8%)에 비하여 유의미하게 많은 비율을 보였다(Table 2). 또한 알츠하이머병 치매와 알츠하이머병에 의한 경도인지장애 환자에서 나이, 한국판 간이정신상태검사, 치매척도검사, 임상치매평가척도, RBDQ-KR, 일상생활 수행능력검사에서 유의미한 차이를 보였으나 성별, 교육 정도, 질병 기간의 항목에서는 유의미한 차이를 보이지 않았다.
나이, 성별, 교육, 유병 기간은 RBD 유무에 따른 양쪽 군에서 유의미한 차이를 보이지 않았다(Table 3). 신경심리검사에서 RBD를 보인 환자군과 보이지 않은 환자군에서 COWAT-supermarket 항목을 제외한 모든 항목에서 통계적으로 유의미한 차이는 보이지 않았다. apolipoprotein E(APOE) ε4를 적어도 1개 이상 보인 환자의 비율 역시 양쪽 군에서 유의미한 차이를 보이지 않았다.
고 찰
본 연구는 아밀로이드 영상검사를 통해 확진한 알츠하이머병 환자를 대상으로 RBD의 빈도를 확인하였다는 점에서 의미가 있다.
이전 연구들은 National Institute of Neurological and Communicative Disorders and Stroke and Alzheimer’s Disease and Related Disorders Association(NINCDS-ADRDA) 진단기준에 따라 임상양상으로 알츠하이머병 치매를 진단하는 경우가 많았다. 하지만 NINCDS-ADRDA 진단기준을 따를 경우 유력 알츠하이머병 치매(probable AD dementia)의 경우 민감도 81%, 특이도 70%, 가능 알츠하이머병 치매(possible AD dementia)의 경우 민감도 93%, 특이도 48%로 특이도가 낮다는 문제점이 있었다[29]. 이에 NIA-AA에서는 표지자(biomarkers)를 기반으로 한 새로운 진단기준을 제시하였으며[30], 최근 이를 통한 진단 및 연구가 활발히 이루어지고 있다. NIA-AA에서 사용한 표지자는 아밀로이드 표지자(amyloid biomarker)와 신경퇴행 표지자(neurodegeneration marker)로 구분할 수 있다. 아밀로이드 표지자는 영상검사와 뇌척수검사를 통해 아밀로이드의 유무로 확인할 수 있다. 그리고 신경퇴행 표지자는 MRI 영상에서 관찰되는 내측 측두엽 위축과 F-18 fluorodeoxyglucose-PET에서 관찰되는 특징적인 대사저하, 그리고 뇌척수검사에서 타우단백의 증가를 관찰함으로써 평가할 수 있다[21]. 본 연구에 포함된 모든 환자들은 뇌 MRI와 아밀로이드 PET 촬영을 하여 뇌조직의 아밀로이드 침착을 확인하였다. 아밀로이드 양전자단층촬영에는 fluemetamol, florobetaben florbetapir 세 종류의 리간드가 사용된다. 뇌 부검연구와 아밀로이드 PET를 비교한 이전 연구에서 이들 검사의 민감도는 각각 88%, 97.9%, 92%, 특이도는 각각 88%, 88.9%, 100%로 보고된 바 있다[31-33]. 본 연구에서는 flutemetamol과 florobetaben을 리간드로 사용한 양전자단층촬영을 이용하여 아밀로이드 바이오마커를 확인한 환자들을 대상으로 하였다.
RBD 유무를 평가하기 위해서 본 연구에서는 RBDQ-KR 설문을 이용하였다. 기존에 많이 사용되어 온 the RBD screening questionnaire(RBDSQ)는 10문항(총 13점)으로 이루어져 있고, 절단점을 5점으로 하였을 때 96%의 민감도와 56%의 특이도로 RBD를 간편하게 평가할 수 있는 장점이 있으나, 예/아니오로 답이 구성되어 있기 때문에 증상의 중증도와 빈도를 반영하기 힘든 단점이 있었다[34]. 그리고 한국어 버전으로 개발된 RBDSQ-Korean version(RBDSQ-K)는 RBD에 대하여 건강한 대상자에 대해서는 정상인과 폐쇄성 수면무호흡을 가진 환자의 절단점을 달리 제시하고 있어 수면다원검사를 시행하지 않은 상황에서 적용하기 어렵다는 제한점이 있었다[24]. 또한 16개의 문항으로 이루어져 있는 Mayo sleep questionnaire(MSQ)는 노인, 치매 환자를 대상으로 RBD 선별을 위한 타당성 평가에서 민감도 98%, 타당도 74%를 보였으나, RBD와 관련된 질문은 한 문항으로, 세부 문항을 포함하더라도 5개에 불가하다는 단점이 있다[35]. 본 연구에서 사용한 RBDQ-KR은 RBDSQ와는 달리 설문을 통하여 증상의 빈도와 중등도를 평가할 수 있고, 수면다원검사를 하지 않고도 93.3%의 민감도와 89.5%의 특이도 RBD를 선별할 수 있다는 장점이 있다[20].
RBD는 뇌간의 배외측 피개신경핵(laterodorsal tegmental nucleus), 피개 각교신경핵(pedunculopontine nucleus), 청반핵(locus coerulues) 등 렘수면을 관장하는 뇌간 구조물들 간 연결망의 변화로 인해 발생하는 것으로 알려져 있다[36]. Braak 등이 발표한 병리학적 단계에 의하면 알파시누클레인 단백질의 축적으로 형성된 레비체가 뇌간의 제일 아래인 연수에서부터 대뇌피질까지 올라가는 양상으로 진행된다고 알려져 있어 파킨슨병, 다계통위축증 등 시누클레인병증의 환자에게서 RBD가 전구증상으로 관찰되는 경우가 흔하다[37]. 알츠하이머병의 경우에도 레비체를 동반하는 경우가 많지만, 레비체병(Lewy body disease)과는 달리 대뇌피질과 변연계에 주로 침착되기 때문에 RBD가 동반되는 경우는 흔치 않은 것으로 알려져 있다.
이전 논문들에 의하면 알츠하이머병에서 RBD의 발생률은 3%에서 11%로 보고되고 있다[12]. 최근의 단면조사 연구에서도 105명의 AD 환자 중 MSQ 설문에서 RBD가 의심되는 환자 15명 중 실제 수면다원검사상 RBD로 확진한 경우는 5명(4.8%)이었고, RBD는 질환의 기간과 연관이 있어 알츠하이머병 치매 후기에 관찰된다는 보고가 있다[38]. 장기간의 코호트 연구에서도 비슷한 빈도를 보고하고 있다. Postuma 등이 12년에 거쳐 93명의 원발성 RBD 환자를 추적관찰한 결과 26명에서 퇴행성 질환이 발생했고, 그중에서 AD로 진단한 경우는 4%였다고 하였다[39]. 그리고 또 다른 연구에서 91명의 원발성 RBD를 추적관찰한 결과 8명(8.8%)에서 AD가 발생했다고 보고하였다[40]. 하지만 대부분의 연구에서 AD의 진단기준으로 NINCDS-ADRDA, Diagnostic and Statistical Manual of Mental Disorders, 4th edition 등의 임상 진단기준을 사용하는 경우가 대부분이었고, 진단기준을 밝히지 않은 경우도 있었다.
본 연구에서는 AD 환자의 24.6%에서 RBD가 관찰되었다. 이는 기존의 연구결과보다 높은 빈도이다. 하지만 RBDSQK를 이용한 최근 연구에서 23명의 AD 환자들 중 9명(39%)에서 RBD가 관찰된다는 보고가 있었다[41]. 이는 본 연구에서 보이는 결과와 유사한 결과이다. 이 연구도 RBD의 진단에 설문지를 이용하였다는 공통점이 있지만, AD의 진단기준으로 임상적인 진단기준(NINCDS-ADRDA criteria)을 사용하였다는 점에서 본 연구와 차이가 있다. 물론 원발성 RBD를 장기간 추적관찰한 연구들에서 훨씬 낮은 빈도로 AD의 발생을 보고하고 있으므로, 본 연구에서 AD 환자에서 관찰되는 RBD의 빈도는 과평가되었을 가능성이 있지만, 이전 연구에서 알츠하이머병 환자들의 병리소견을 확인한 결과 40~50%에서 레비체가 관찰된다는 연구결과를 고려해 보면 알츠하이머병 환자들에게 RBD 증상이 관찰되는 원인으로 시누클레인병증으로 인한 레비체 병리를 공유하는 것이 하나의 원인이라고 생각할 수 있다[13-17].
이전 연구에서는 레비체를 보인 알츠하이머병 환자가 레비체를 보이지 않는 환자에 비하여 APOE ε4의 빈도가 높았다는 보고와 더 낮았다는 보고가 함께 있었다[41,42]. 우리 연구에서도 APOE ε4의 유무에 따라 RBD 동반 여부를 확인하였으나 통계학적으로 유의미한 차이는 없었다. 이는 이전 연구에서 레비체 동반 여부에 따른 알츠하이머병 환자에서 APOE ε4 발견 빈도가 차이가 없다는 결과와 일치한다[43,44].
인지기능을 살펴보면 RBD를 동반한 환자와 동반하지 않은 환자를 비교하였을 때 SNSB를 통한 자세한 신경심리검사에서 COWAT-supermarket을 제외한 모든 항목에서 양쪽 환자들 사이에 유의미한 차이는 보이지 않았다. 주의집중력, 기억력, 언어능력, 전두엽 집행기능을 포함한 모든 항목에서 유의미한 차이가 없었기 때문에 한 가지 항목의 차이만을 가지고 RBD에 따라 인지기능의 차이가 있다고 보기는 어려울 것으로 사료된다. 하지만 실행력(executive function)이 RBD 환자에서 향후 퇴행성 질환을 예측할 수 있는 인지라는 이전의 연구결과를 고려한다면 충분한 환자 수를 확보한 후속연구가 필요할 것이다[12].
본 연구는 NIA-AA 기준으로 진단한 알츠하이머병 환자들 중 양전자단층촬영을 통하여 아밀로이드 병리소견을 확인한 환자들만 대상으로 RBD의 발생률을 확인하였다는 점에서 의의가 있다. 하지만 RBD를 수면다원검사가 아닌 설문으로 진단했다는 제한점이 있다. 그리고 RBD를 보인 환자들의 파킨슨 증상의 동반 여부를 확인하지 못한 제한점이 있다. 향후 이 환자들에 대하여 단일화된 파킨슨병 계측 척도(unified Parkinson’s disease rating scle)를 시행하여 파킨슨병 증상 여부를 확인한다면 더 의미 있는 결과를 얻을 수 있을 것으로 기대한다. 그리고 충분한 표본수를 확보하지 못하여 통계학적 검증력이 높지 않았다는 점 또한 본 연구의 제한점이다. 그러므로 향후 수면다원검사를 통해 확진한 충분한 환자군을 대상으로 한 연구가 필요할 것으로 사료된다.
결론적으로 알츠하이머병 환자에서 RBD가 드물지 않게 관찰될 수 있는 것으로 보이며, RBD를 동반한 치매를 진단함에 있어서, 레비체 치매뿐 아니라 알츠하이머병을 감별진단으로 고려할 필요가 있다.
Notes
The authors have no potential conflicts of interest to disclose.
Author Contributions
Conceptualization: Hyun-Suk Kim, Hyun Joon Lee, Dong-Jin Shin, Yeong-Bae Lee, Young Noh, Kee Hyung Park. Data curation: Hyun-Suk Kim, Kee Hyung Park. Formal analysis: Hyun-Suk Kim, Hyun Joon Lee, Kee Hyung Park. Investigation: Hyun-Suk Kim, Kee Hyung Park. Methodology: Kee Hyung Park. Supervision: Kee Hyung Park. Writing—original draf: Hyun-Suk Kim, Hyun Joon Lee, Kee Hyung Park. Writing—review & editing: Hyun Jun Lee, Kee Hyung Park.