AbstractObjectivesNicotine stimulates release of neurotransmitters that regulate the sleep-wake cycle and thereby leads to insomnia. Smoking is associated with upper airway distress; however, its role in severe sleep-related breathing disorders remains controversial. In this study, we investigated the effects of smoking on obstructive sleep apnea (OSA).
MethodsWe investigated 1,163 patients diagnosed with OSA who underwent polysomnography between March 2020 and July 2022. We recorded details including smoking status (current, former, and non-smoker), demographics, questionnaire-related data, and polysomnography findings and performed univariate analysis to compare these variables between smokers and non-smokers. We also analyzed the correlation between smoking status and OSA severity. The risk of smoking on the severity of OSA was determined using logistic regression analysis.
ResultsCurrent and former smokers included 461 male (49.1%) and 10 female (4.4%) (p=0.001). Smokers had a high apnea-hypopnea index (AHI) and oxygen desaturation index (ODI) (p<0.001), high arousal index (p=0.001), and severe daytime sleepiness (indicated by the Epworth Sleepiness Scale, p<0.001). We observed no correlation between the AHI and the number of cigarettes smoked per day and the duration of smoking. Logistic regression analysis after adjustment for age, sex, body mass index, and alcohol consumption showed that smoking was a risk factor for ODI (ODI >15, odds ratio 1.33, p=0.04), and AHI was independent of smoking.
서 론폐쇄성 수면무호흡증(obstructive sleep apnea, OSA)은 구조적으로 상기도 및 인두부 협착으로 인해 발생된 공기흐름(airflow)저하와, 이로 인한 일시적인 산소포화도 저하 및 과도한 각성을 유발하는 수면관련호흡장애(sleep-related breathing disorder)의 한 분류이다[1]. 이러한 병태생리학적 기전은 야간 수면의 질 저하를 유발하며 주간과다졸림, 집중력 저하, 인지기능 저하 등의 주간증상으로 나타나고 장기적으로는 심, 뇌혈관 질환의 위험인자가 된다[2-5].
OSA의 위험인자로는 연령, 비만, 음주력, 남자 등이 있으며, 이들은 결과적으로 기류저하를 악화시킬 수 있는 해부학적 구조 변화의 발생을 높이는 요인들이다[6]. 흡연이 상기도에 미치는 영향 및 각성효과는 잘 알려져 있으며 이러한 관점에서 흡연과 수면장애 간의 관련성에 대해 여러 연구들이 진행되었다.
흡연은 심, 뇌혈관 질환 및 암, 폐쇄성 폐질환 등 다양한 질환에서 위험인자이다[7]. 수면장애 측면에서는 흡연을 통해 흡수된 니코틴이 중요한 역할을 하게 되는데, 니코틴은 심박수, 혈압, 혈중 카테콜아민 농도를 증가시키며 대뇌 신경계에는 수면-각성 주기(sleep-wake cycle)를 조절하는 신경전달물질의 분비를 촉진시켜 불면증에 이르게 한다[8,9].
또한 흡연에 의한 상기도 해부학적 변화는 OSA와 관련성이 높을 것이라는 가설은 많은 연구자들의 관심 대상이었다. 그러나 흡연의 각성효과에 대해서 일치되는 의견과는 달리 OSA에서 흡연의 영향은 연구자들마다 다양한 결과를 보고하였다. 위스콘신 코호트 연구에서는 흡연자에서 코골이와 OSA의 발생률이 2배 이상 높다고 하였다[10]. 그러나 총 5,264명의 대상자들로 진행된 메타분석 연구에서는 흡연이 OSA 발생에 미치는 영향을 입증하지 못하였다[11]. 발생률과 흡연과의 관련성 뿐만 아니라 OSA의 중증도에 대한 위험인자로써의 흡연에 대해서도 상반된 결과를 확인 할 수 있다. 연령, 체질량지수(body mass index, BMI), 성별을 보정하였을 때 무호흡-저호흡지수(apnea-hypopnea index, AHI)는 흡연에 독립적인 변수였다[12]. 다른 연구에서는 다중회귀분석에서 흡연과 AHI 간에 유의한 상관관계가 있음을 보고하였다[13]. 이와 같이 흡연과 OSA 간에 상반되는 결과가 보고되는 이유는 연구에 참여하는 대상자의 특성 및 분석방법의 차이인 것으로 생각된다.
OSA의 임상적 증상과 합병증은 수면 중 빈번한 산소포화도 저하와 각성에서 시작된다. 그러나 산소포화도 저하 관점에서 흡연과 OSA의 관계에 대한 연구는 많지 않다. 따라서 본 연구에서는 AHI에 따른 OSA의 중증도와 산소포화도 변화에 대해 흡연이 미치는 영향과 그 위험도를 전반적인 수면다원검사 지표 및 임상자료를 바탕으로 확인하고자 한다.
방 법연구대상 및 평가방법본 연구는 2020년 3월부터 2022년 7월 사이의 의무 기록을 후향적으로 분석하여 진행되었다. 서울의 한 대학병원 수면 클리닉에서 코골이, 수면 중 무호흡 및 주간과다졸림으로 내원하여 수면다원검사 시행 후 OSA로 진단받은 20세 이상 성인 환자가 포함되었다. 야간 수면다원검사는 Remlogic(Embla system, Denver, CO, USA) 프로그램을 사용하였다. 뇌파(C3-A2, C4-A1, F3-A2, F4-A1, O1-A2, O2-A1), 4채널 안전위도(electro-oculography) 및 턱 근전도로 수면 단계와 각성을 판정하였으며 흉곽과 복부벨트를 이용하여 호흡운동을 측정하였다. 호흡량은 온도감지센서와 압력센서로 측정하였으며 심전도, 양측 전경골근(anterior tibialis)에 부착한 2채널의 근전도, 맥박산소측정(pulse oximetry)을 측정하였다. 수면다원검사는 American Academy of Sleep Medicine Manual에 근거하여 판독되었다[14]. 비강의 온도와 압력센서를 통해 측정된 공기흐름이 90% 이상 감소한 상태가 10초 이상 지속될 경우 무호흡(apnea)으로 정의하였으며, 30% 이상 공기흐름의 감소가 10초 이상 유지되면서 산소포화도가 4% 이상 감소하거나 뇌파 상 각성이 관찰되는 경우는 저호흡(hypopnea)으로 정의하였다. 시간당 무호흡과 저호흡의 빈도를 합하여 AHI를 계산하였다. OSA는 AHI가 5 이상이면서 무호흡, 코골이 및 주간과다졸림 등이 동반된 경우 진단되었다. 그리고 AHI를 5, 15, 30을 기준으로 하여 그 이상인 경우를 각각 경도, 중등도 및 고도 수면무호흡증으로 3단계 분류하였다. 산소불포화지수(oxygen desaturation index, ODI)는 기저 산소포화도에서 3% 이상 산소포화도가 감소한 빈도를 시간당 비율로 계산하였다. ODI의 중증도 분류 기준은 아직 명확히 정해진 바는 없으나, 본 연구에서는 AHI와 동일한 수치를 기준으로 3단계로 분류하였고, 이는 이전에 진행된 여러 연구 방법에 근거하였다[15].
그리고 나이, 성별, BMI, 음주력, 흡연력, 수면의질과 관련된 설문지가 분석항목으로 포함되었다. 음주력과 흡연력은 수면다원검사 당일 시행하는 설문지에서 기술된 내용이 바탕이 되었다. 음주력은 술을 전혀 마시지 않는 비음주자와 그렇지 않은 음주자로 분류하였으며, 흡연력은 현재 흡연자(current smoker), 금연자(former smoker), 비흡연자(nonsmoker)로 세 군으로 분류하여 흡연상태를 평가하였다. 현재 흡연 중인 경우에는 하루 흡연량(갑/day), 총 흡연기간(년), 그리고 두 지표에서 갑년(pack-year)을 계산하였다. 금연상태는 마지막 흡연이 최소 6개월 이상으로 금연상태가 유지되는 경우로 정의하였다. 주간과다졸림은 Epworth Sleepiness Scale이 10점 이상인 경우를 동반된 것으로 판단하였으며, Insomnia Severity Index, Beck Depression Inventory 및 Pittsburgh Sleep Quality Index로 불면증, 우울증 및 전반적인 수면의 질을 평가하였다. 본 연구에 사용된 연구기준, 방법 및 평가는 기관윤리심의위원회의 심의(승인번호 2022-10-058)와 동의 면제 승인을 획득하였으며, 기관윤리심의위원회의 관리감독 하에 시행되었다.
통계 방법연속형으로 측정된 변수는 평균과 분산으로 기술하였으며 통계적 유의성은 독립 t검정으로 확인하였다. 범주형 변수는 빈도(n)와 비율(%)로 기술하였으며 카이제곱검정 결과로 유의성을 판단하였다. 세 그룹 이상에 대해서는 분산분석으로 비교하였으며 각 그룹 간의 짝지은 비교는 Tukey로 사후분석 하였다. 흡연자와 비흡연자 간의 인구학적 및 신체적 특성 차이를 고려하여 성향 점수 매칭(propensity score matching)하여 추가 비교하였다. 또한 하루 흡연량 및 총 갑년과 OSA의 중증도 관계는 상관분석으로 유의성을 평가하였다. OSA의 중증도에 대한 흡연의 위험도는 성별, 나이, BMI, 음주력을 보정하여 로지스틱 회귀분석으로 측정하였다. 통계 분석은 R version 4.2.0 (R Core Team, R Foundation for Statistical Computing, Vienna, Austria)을 이용하였다.
결 과흡연 여부에 따른 대상자들의 특성연구에 포함된 총 대상자 수는 1,163명이었으며 흡연력이 전혀 없는 비흡연자는 692명, 금연자를 포함한 흡연력이 있는 환자는 471명이었다. 평균 연령은 차이가 없었으며 성별 차이는 흡연자에서 남성의 비율이 유의하게 높았다(97.9% vs. 68.9%, p<0.001). BMI도 흡연자에서 높았으며(27.1±4.0 kg/m2 vs. 26.5±4.5 kg/m2, p=0.014) 25를 기준으로 그 이상인 비만의 비율도 흡연자에서 높았다(71.5% vs. 61.1%, p<0.001). 또한 흡연자에서 높은 음주력(50.1% vs. 27.5%, p<0.001)과 심한 주간과다졸림을 확인할 수 있었다(10.3±4.7 vs. 9.1±4.5, p<0.001). 전반적인 수면의 질과 불면증, 우울감은 차이가 없었다(Table 1).
수면다원검사 지표의 비교에서는 흡연자군이 AHI가 높았으며(36.7±23.0 vs. 31.3±21.0, p<0.001) 중등도 및 고도 이상의 OSA 비율도 유의하게 높았다(AHI>15, 83.4% vs. 78.3%, p=0.037; AHI>30, 53.9% vs. 44.2%, p=0.001). 또한 AHI는 수면 단계에 따라 차이를 보였다. 렘수면에서는 두 군에서 차이가 없었고, 비렘수면에서는 흡연자에서 AHI가 높았다(35.9±24.7 vs. 29.7±22.5, p<0.001). ODI 또한 흡연자에서 높았으며(30.4±22.7 vs. 25.0±20.6, p=0.001) 15와 30 기준으로 분류하였을 때 중등도 및 고도 이상의 ODI 비율도 흡연자에서 높았다(ODI>15, 72.0% vs. 60.5%, p<0.001; ODI>30, 43.1% vs. 33.2%, p=0.001, repectively). 수면다원검사 동안 가장 낮은 산소포화도(lowest saturation)와 기저 평균 산소포화도(baseline sleep saturation)의 비교에서는 흡연자에서 더 낮은 경향을 보였다(lowest saturation, 81.4±8.2 vs. 82.3±7.8, p=0.016; baseline sleep saturation, 95.0±2.1 vs. 95.3±2.5, p=0.048). 수면잠복기는 차이가 없었으며 각성 지수는 흡연자에서 높았으나(32.0±17.2 vs. 28.8±15.4, p=0.001), 수면 중 기상(wake after sleep onset)은 비흡연자에서 높았다(14.9±10.2 vs. 16.2±11.9, p=0.044). 수면 구조의 특성은 흡연자에서 높은 N1의 비율과(23.7±13.3 vs. 21.1±12.3, p=0.001) 유의하게 낮은 N3 비율을 볼 수 있었다(4.7±6.4 vs. 6.5±8.5, p<0.001) (Table 2).
흡연자들은 남성의 비율 및 음주력이 높은 특성을 보이며 이는 OSA의 중증도에 영향을 미칠 수 있는 요인임을 고려하여 성향 점수 매칭을 통해 추가적으로 단변량 분석을 시행하였다. 매칭 과정을 통해 두 군은 각각 471명으로 1:1 매칭되었으며 유의한 차이를 보였던 변수인 BMI (71.5% vs. 66.7%, p=0.12)와 중등도 및 고도 이상의 AHI 비율(AHI>15, 83.4% vs. 81.1%, p=0.39; AHI>30, 53.9% vs. 48.2%, p=0.09), 수면효율(82.9±10.9 vs. 82.6±11.4, p=0.72), N3 비율(4.7±6.4 vs. 5.3±7.1, p=0.21)이 매칭 후에는 통계적 차이를 보이지 않았다.
흡연량 및 흡연기간과 수면무호흡증 중증도현재 흡연상태, 흡연량 및 흡연기간과 수면무호흡증 증증도 간의 상관관계를 확인하기 위하여 분산분석(ANOVA)과 다중회귀분석을 시행하였다(Fig. 1 and Table 3). 흡연상태는 흡연자, 금연자, 비흡연자로 세 군으로 분류하여 AHI와 ODI에 대해 분산분석 및 사후분석으로 비교하였다. 세 군의 AHI는 유의한 차이를 보였으며(p<0.001) 사후분석에서 흡연자와 비흡연자 및 금연자와 비흡연자 간의 비교에서 모두 유의하게 비흡연자의 AHI가 낮은 것을 확인할 수 있었다(p<0.001 and p=0.003, respectively). 그러나 흡연자와 금연자 사이에는 AHI의 차이가 없었다(p=0.97). ODI에 대해서도 같은 방법으로 비교하였으며 AHI와 동일한 결과를 보였다. 흡연자와 비흡연자, 금연자와 비흡연자 간에는 ODI의 차이가 유의하였으나 흡연자와 금연자 간에는 차이를 확인할 수 없었다(p=0.69).
하루 흡연량 및 흡연기간을 통해 계산된 갑년과 AHI와 ODI 간의 관계를 보고자 다중회귀분석을 시행하였다. 보정을 위해 연령과 BMI를 포함하였으며 AHI와 ODI 모두 흡연량과 갑년과의 선형적 연관성이 보이지 않았다.
수면무호흡증 중증도의 위험인자로써의 흡연로지스틱 회귀분석을 통해 흡연이 OSA의 중증도에 미치는 위험도를 평가하였다(Fig. 2). OSA의 위험인자로 알려진 성별, 나이, BMI, 음주력을 보정하여 중등도 이상의 AHI와 ODI에 대한 위험도를 분석한 결과 AHI는 남자(odds ratio [OR] 1.89, p=0.001), 60세 이상 나이(OR 2.20, p<0.001) 및 음주력(OR 1.45, p=0.02)이 위험인자로 확인되었으나 흡연력에 대해서는 독립적이었다(OR 1.07, p=0.66). ODI는 남자(OR 1.90, p<0.001), 60세 이상 나이(OR 1.83, p<0.001), BMI 25 이상(OR 2.28, p<0.001) 및 흡연력(OR 1.33, p=0.04)이 위험인자였다.
고 찰본 연구 결과 흡연이 OSA에서 ODI에 대해서는 위험요인임을 확인하였으며 흡연자의 수면다원검사에서 잦은 각성과 전반적으로 낮은 산소포화도, 낮은 N3의 비율로 수면의 질이 떨어지는 것을 알 수 있었다. 그러나 AHI에 대한 흡연 위험도는 예상과는 달리 유의성을 밝히지 못하였다. 또한 하루 흡연량 및 총 갑년으로 측정된 흡연의 강도와 AHI 및 ODI 간의 상관관계 및 흡연과 금연 사이에 OSA의 중증도 차이도 확인할 수 없었다.
흡연이 수면에 미치는 영향에 대해서는 수면장애 마다 다소 차이가 있다. 불면증을 악화시키는 요인으로써의 흡연의 역할에 대해서는 어느정도 일치된 의견이 있으나 OSA와의 관계에 대해서는 연구마다 결과가 차이를 보인다. 그 이유를 몇 가지 추정해 보자면, 첫번째로는 연구에 포함된 대상자들의 특성 차이이다. 연구 관점은 크게 흡연이 OSA의 발생률에 미치는 영향과 OSA로 진단받은 환자의 중증도 악화요인으로 나눌 수가 있으며, 연구 방향에 따라 참여 대상자의 특성이 달라지게 되어 상반된 결과가 나오는 원인 중 하나로 생각된다.
그리고 통계 분석 방법의 차이도 고려해볼 필요가 있다. 본 연구에서는 성별, 나이, BMI, 음주력을 보정하여 시행한 로지스틱 분석에서 흡연이 OSA에서 ODI 지표의 악화에는 관련이 있었으나 AHI는 흡연에 독립적인 요인이었다는 점을 확인하였다. 흡연이 AHI 중증도의 위험요인으로 보고한 여러 연구에서 단변량 분석 및 선형관계의 결과로 가설을 입증하였다[13,16]. 그러나 저자들이 자료를 분석하는 과정에서 대상자들의 특성이 OSA 중증도에 영향을 미치는 변수의 차이가 그룹마다 차이가 크다는 점을 알 수 있었으며, 이러한 요인들의 보정없이 단변량 분석만으로는 결과 해석에 주의가 필요했다.
단변량 분석에서 흡연자는 비흡연자에 비해 AHI의 수치가 높았으며 중등도 이상(AHI>15)의 OSA 비율도 높았다. 또한 설문지를 통한 주관적 증상에서도 주간과다졸림이 심했으며 수면다원검사 지표에서는 높은 ODI, 짧은 N3단계, 낮은 수면효율 및 높은 각성지수를 보였다. 렘수면에서의 AHI는 차이가 없었으나 비렘수면에서 AHI는 흡연군에서 높았다. 그러나 앞서 언급한바와 같이 환자들의 흡연에 따른 생활 습관 및 인구학적 특성 차이에 대해 보정이 필요하였으며 성향 점수 매칭 후에는 다소 다른 결과를 확인할 수 있었다. AHI의 지표는 유의하게 높았으나 중등도 이상의 비율은 통계적 유의성이 사라졌다. 그러나 ODI는 매칭 전, 후로 지표 및 중등도 이상의 비율 모두 흡연자에서 높았다. 이 결과는 AHI보다는 ODI가 일관되게 OSA의 중증도에 대해 흡연의 영향을 반영할 수 있는 지표임을 시사한다.
흡연의 강도에 따른 OSA의 중증도는 차이를 확인할 수 없었다. 우선 흡연 상태에 따라 흡연자, 금연자, 비흡연자로 분류하였을 때 흡연자와 금연자 간의 AHI와 ODI의 차이가 없었다. 그리고 하루 흡연량과 흡연 기간에 따른 갑년, 금연 후 기간과의 AHI, ODI 간에도 상관관계를 보이지 않았다. 흡연 상태와 AHI 간의 통계적 유의성이 없는 것은 이전 연구 결과와 일치하는 부분이다[16]. 그리고 본 연구에서 OSA를 경도, 중등도, 고도 3단계로 분류하여 중증도가 높아질수록 흡연 갑년이 늘어난다고 하였으나, 분산분석 외에 사후분석 결과는 따로 언급하지 않아 통계적인 결과의 한계를 감안할 필요가 있다.
또 다른 연구 결과에 따르면, AHI가 50 이상인 환자에서 흡연량이 더 많았으며 30갑년 이상의 흡연자는 비흡연자보다 AHI가 더 높았다. 그러나 나이, 성별, BMI를 보정하였을 때는 흡연량과 AHI의 중증도가 유의하지 않았다[12]. 이와 같이 흡연 강도와 OSA에 대해서는 추가적인 연구가 필요하다.
ODI는 기저 산소포화도에서 시간당 3% 이상 산소포화도가 감소된 횟수를 지표로 나타낸 것이다. OSA에서 주간과다졸림이 동반된 경우 짧은 수면 잠복기와 높은 수면 효율을 보임에도 불구하고 보다 불량한 야간 산소포화도에 의해 증상이 발현된 것으로 판단하였으며 이는 산소포화도가 임상적 증상에 미치는 영향이 중요함을 시사한다[17]. 또한 높은 ODI 중증도와 낮은 수면 평균 산소포화도는 경동맥 및 관상동맥 죽상경화반을 악화시키며 정상적인 야간 혈압 하강(nocturnal blood pressure dipping)의 감소를 유발하여 결과적으로는 심혈관 질환의 위험을 증가시킨다[18-21]. 따라서 주관적 증상 및 심혈관계 질환 위험도와 산소포화도 간의 관련성 측면 및 AHI가 비정상적 호흡발생의 강도 측정에는 한계가 있다는 점에 대해 AHI의 보완적 지표로써 ODI에 의미를 찾기 위한 노력이 있었다.
AHI 5를 기준으로 하여 그 이상인 경우에 1.9%를 제외하고는 ODI와 AHI 간에 일치도를 보였다[22]. 그리고 아직 ODI의 중증도에 대한 단계별 구분이 일치된 의견은 없지만 AHI와 동일하게 ODI를 경도는 5, 중등도는 15, 고도는 30으로 분류하여 AHI와의 일치도를 비교하였을 때 ODI가 5 이상은 87%, 15 이상은 84%, 30 이상은 93.7%의 일치도를 보였으며, OSA의 합병증과 사망률은 야간 저산소증과 관련있고 ODI는 예후 예측 인자로써의 가치가 있음을 보고하였다[15].
그러나 ODI와 AHI 간 일치도가 예외적인 상황도 고려해야 하는데 고령과 비만인 경우에서 다소 차이를 보였다. 특히 고령은 심폐질환이 동반된 경우가 많고 이 질환에 의해 ODI가 영향을 받는 것으로 생각된다[22].
본 연구에서도 결과적으로는 OSA의 중증도에서 위험인자로 ODI만이 유의성을 확인할 수 있었고 이는 ODI와 AHI의 일치도 차이를 의미하며, 흡연이 상기도에 미치는 효과 측면에서 원인을 추정해보고자 하였다.
흡연에 노출되면 상기도 중 특히 소기도(small airway) 및 폐 실질의 염증을 유발하게 된다. 이로 인해 소기도벽의 두께가 두꺼워지고 구조적으로 손상을 입으면서 기도의 저항성 증가와 폐의 탄성도 감소로 인해 기류 흐름에 제한이 생기게 된다[23]. 또한 일산화탄소확산능 검사(diffusing capacity of the lung for CO)에서는 비흡연자에 비해 흡연자에서 가스 교환의 저하가 뚜렷하다. 그리고 운동시 가스교환의 효율은 더욱더 떨어지는데 산소요구량이 늘어나는 상황에서 혈액과 폐 모세혈관 간의 교환시간이 줄어들기 때문으로 생각된다[24]. OSA 발생의 병리기전인 상기도 협착은 인두주위의 해부학적 요인, 각종 수용기의 민감도, 인두개통을 유지하는 여러 반사들의 기능 저하로 발생하게 된다[25]. 그러나 흡연의 해부병리학적 변화의 대상이 주로 소기도와 폐 실질이라는 점은 상기도 협착에 의한 공기흐름을 반영하는 AHI의 중증도에는 다소 영향을 적게 미치는 것으로 생각된다.
본 연구에는 몇 가지 한계점이 있다. OSA 환자를 대상으로 흡연이 중증도에 미치는 영향을 확인하였기 때문에 흡연이 수면무호흡증의 발생률에 미치는 영향에 대해서는 본 연구로는 확인이 어렵다. 또한 위험인자로써 AHI와 ODI가 서로 차이를 보였던 점에 대한 가설에 대해 폐기능검사 및 일산화탄소확산능 검사로 확인했다면 흡연이 OSA에 미치는 영향에 대해 보다 더 객관적으로 접근할 수 있었을 것이다. 그리고 하루 흡연량과 흡연 기간에 따른 갑년이 OSA의 중증도와 통계적으로 유의성은 밝히지 못하였는데 흡연력 정보가 작성된 설문지의 한계도 한 이유로 생각된다. 일반적으로 흡연자의 경우 하루 흡연량을 정확하게 개피수 보다는 대략적으로 반갑 또는 한갑으로 기술하는 경우가 많아 이런 부분이 정확한 흡연강도와 중증도간 상관관계를 평가하기 어려웠던 점으로 생각된다.
수면무호흡증과 관련성이 높을 것으로 생각된 흡연자의 특성과 위험인자로써의 흡연에 대해 확인하였다. OSA에서 흡연이 ODI의 위험 인자였으며, 성향 점수 매칭 후 비교에서도 AHI는 차이가 없었지만 ODI는 통계적 유의성을 계속 보여주었다. 이는 흡연이 OSA에서 산소포화도 저하에 관여하는 것을 의미하며 임상적 증상 발현에도 중요한 요인임을 알 수 있다. 본 연구 결과는 OSA의 저산소 및 산소포화도 측면에서 바라본 기전적 특성 및 임상양상에 대한 향후 연구의 방향 제시에 도움이 될 것으로 생각한다.
NotesAuthor Contributions
Conceptualization: Min Jae Seong, Eun Yeon Joo. Data curation: Sujin Lee, Min Jae Seong. Formal analysis: Min Jae Seong, Eun Yeon Joo. Investigation: Min Jae Seong, Eun Yeon Joo. Methodology: all authors. Project administration: Eun Yeon Joo. Resources: Min Jae Seong, Eun Yeon Joo. Software: Sujin Lee, Min Jae Seong. Supervision: Eun Yeon Joo. Validation: Min Jae Seong, Eun Yeon Joo. Visualization: Sujin Lee, Min Jae Seong. Writing—original draft: all authors. Writing—review & editing: Min Jae Seong, Eun Yeon Joo.
Figure 1.Effect of smoking status on AHI (A) and ODI (B) as analyzed by ANOVA. AHI, apnea-hypopnea index; ODI, oxygen desaturation index. 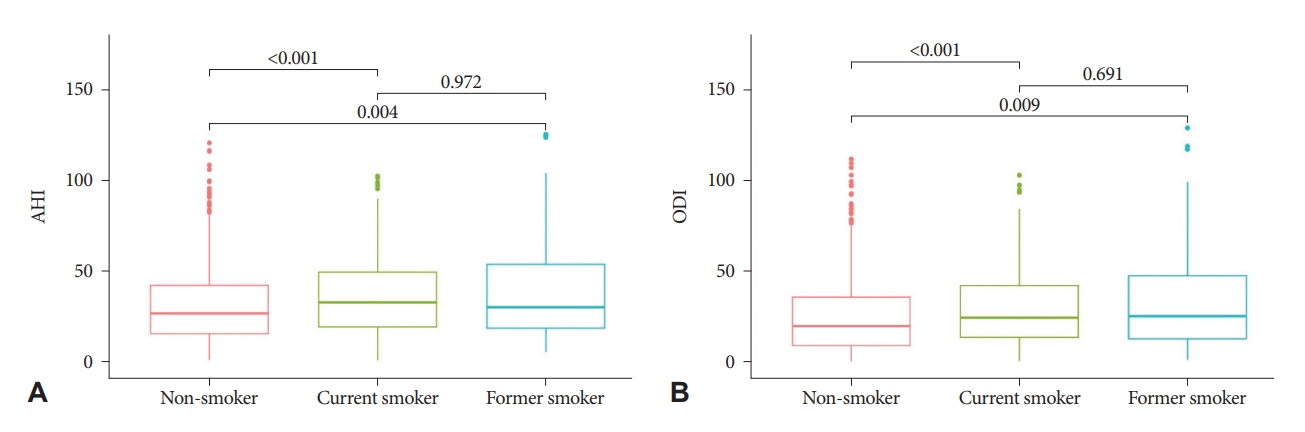
Figure 2.OR for smoking as a risk factor for obstructive sleep apnea severity assessed by AHI (A) and ODI (B). AHI, apnea-hypopnea index; ODI, oxygen desaturation index; OR, odds ratio; CI, confidence interval; BMI, body mass index. 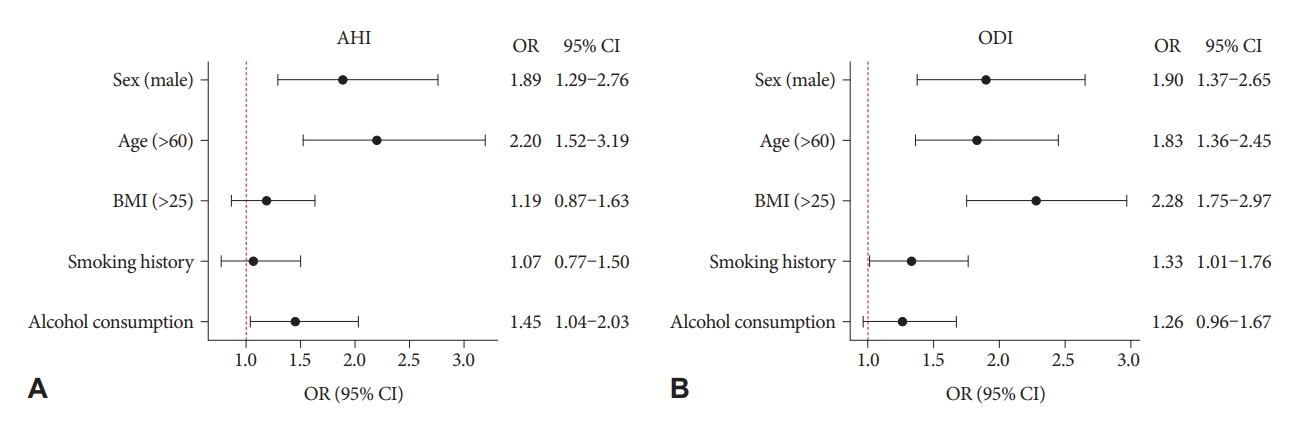
Table 1.Demographics and questionnaire results of participants (n=1,163) Table 2.Characteristics of polysomnography findings according to smoking status (n=1,163) Table 3.Multiple linear regression analysis to identify variables affecting AHI REFERENCES1. Sateia MJ. International classification of sleep disorders-third edition: highlights and modifications. Chest 2014;146:1387-1394. https://doi.org/10.1378/chest.14-0970.
2. Arzt M, Young T, Finn L, Skatrud JB, Bradley TD. Association of sleep-disordered breathing and the occurrence of stroke. Am J Respir Crit Care Med 2005;172:1447-1451. https://doi.org/10.1164/rccm.200505-702OC.
3. Lavie P, Herer P, Hoffstein V. Obstructive sleep apnoea syndrome as a risk factor for hypertension: population study. BMJ 2000;320:479-482. https://doi.org/10.1136/bmj.320.7233.479.
4. Seneviratne U, Puvanendran K. Excessive daytime sleepiness in obstructive sleep apnea: prevalence, severity, and predictors. Sleep Med 2004;5:339-343. https://doi.org/10.1016/j.sleep.2004.01.021.
5. Gagnon K, Baril AA, Gagnon JF, et al. Cognitive impairment in obstructive sleep apnea. Pathol Biol (Paris) 2014;62:233-240. https://doi.org/10.1016/j.patbio.2014.05.015.
6. Young T, Skatrud J, Peppard PE. Risk factors for obstructive sleep apnea in adults. JAMA 2004;291:2013-2016. https://doi.org/10.1001/jama.291.16.2013.
7. Jacobs EJ, Newton CC, Carter BD, et al. What proportion of cancer deaths in the contemporary United States is attributable to cigarette smoking? Ann Epidemiol 2015;25:179-182.e1. https://doi.org/10.1016/j.annepidem.2014.11.008.
8. Yildiz D. Nicotine, its metabolism and an overview of its biological effects. Toxicon 2004;43:619-632. https://doi.org/10.1016/j.toxicon.2004.01.017.
9. Zhang L, Samet J, Caffo B, Punjabi NM. Cigarette smoking and nocturnal sleep architecture. Am J Epidemiol 2006;164:529-537. https://doi.org/10.1093/aje/kwj231.
10. Wetter DW, Young TB, Bidwell TR, Badr MS, Palta M. Smoking as a risk factor for sleep-disordered breathing. Arch Intern Med 1994;154:2219-2224. https://doi.org/10.1001/archinte.1994.00420190121014.
11. Taveira KVM, Kuntze MM, Berretta F, et al. Association between obstructive sleep apnea and alcohol, caffeine and tobacco: a meta-analysis. J Oral Rehabil 2018;45:890-902. https://doi.org/10.1111/joor.12686.
12. Hoflstein V. Relationship between smoking and sleep apnea in clinic population. Sleep 2002;25:517-522. https://doi.org/10.1093/sleep/25.5.517.
13. Yosunkaya S, Kutlu R, Vatansev H. Effects of smokıng on patıents wıth obstructıve sleep apnea syndrome. Clin Respir J 2021;15:147-153. https://doi.org/10.1111/crj.13278.
14. Berry RB, Brooks R, Gamaldo C, et al. AASM scoring manual updates for 2017 (version 2.4). J Clin Sleep Med 2017;13:665-666. https://doi.org/10.5664/jcsm.6576.
15. Chung F, Liao P, Elsaid H, Islam S, Shapiro CM, Sun Y. Oxygen desaturation index from nocturnal oximetry: a sensitive and specific tool to detect sleep-disordered breathing in surgical patients. Anesth Analg 2012;114:993-1000. https://doi.org/10.1213/ANE.0b013e318248f4f5.
16. Varol Y, Anar C, Tuzel OE, Guclu SZ, Ucar ZZ. The impact of active and former smoking on the severity of obstructive sleep apnea. Sleep Breath 2015;19:1279-1284. https://doi.org/10.1007/s11325-015-1159-1.
17. Mediano O, Barceló A, de la Peña M, Gozal D, Agustí A, Barbé F. Daytime sleepiness and polysomnographic variables in sleep apnoea patients. Eur Respir J 2007;30:110-113. https://doi.org/10.1183/09031936.00009506.
18. Baguet JP, Hammer L, Lévy P, et al. The severity of oxygen desaturation is predictive of carotid wall thickening and plaque occurrence. Chest 2005;128:3407-3412. https://doi.org/10.1378/chest.128.5.3407.
19. Hayashi M, Fujimoto K, Urushibata K, Uchikawa S, Imamura H, Kubo K. Nocturnal oxygen desaturation correlates with the severity of coronary atherosclerosis in coronary artery disease. Chest 2003;124:936-941. https://doi.org/10.1378/chest.124.3.936.
20. Seif F, Patel SR, Walia HK, et al. Obstructive sleep apnea and diurnal nondipping hemodynamic indices in patients at increased cardiovascular risk. J Hypertens 2014;32:267-275. https://doi.org/10.1097/HJH.0000000000000011.
21. Kent BD, Garvey JF, Ryan S, Nolan G, Dodd JD, McNicholas WT. Severity of obstructive sleep apnoea predicts coronary artery plaque burden: a coronary computed tomographic angiography study. Eur Respir J 2013;42:1263-1270. https://doi.org/10.1183/09031936.00094812.
22. Fabius TM, Benistant JR, Bekkedam L, van der Palen J, de Jongh FHC, Eijsvogel MMM. Validation of the oxygen desaturation index in the diagnostic workup of obstructive sleep apnea. Sleep Breath 2019;23:57-63. https://doi.org/10.1007/s11325-018-1654-2.
23. Saetta M, Finkelstein R, Cosio MG. Morphological and cellular basis for airflow limitation in smokers. Eur Respir J 1994;7:1505-1515. https://doi.org/10.1183/09031936.94.07081505.
24. Adatia A, Wahab M, Shahid I, Moinuddin A, Killian KJ, Satia I. Effects of cigarette smoke exposure on pulmonary physiology, muscle strength and exercise capacity in a retrospective cohort with 30,000 subjects. PLoS One 2021;16:e0250957. https://doi.org/10.1371/journal.pone.0250957.
25. Patil SP, Schneider H, Schwartz AR, Smith PL. Adult obstructive sleep apnea: pathophysiology and diagnosis. Chest 2007;132:325-337. https://doi.org/10.1378/chest.07-0040.
|
|
||||||||||||||||||||||||||||||||||||||